Les dioxa-1,3 cyclohexanes
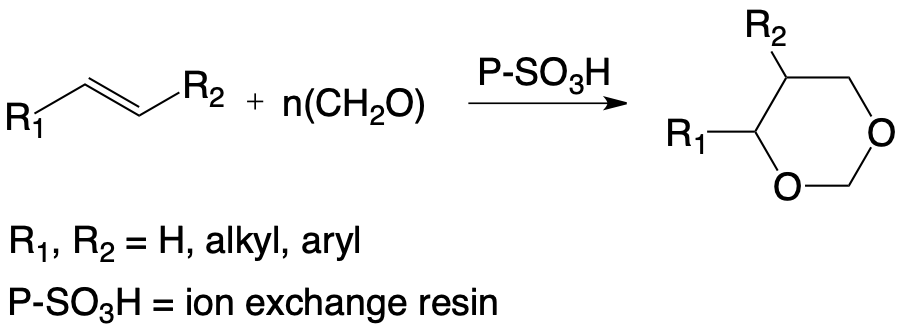
L’utilisation de résines échangeuses d’ions acides fortes permet de condenser sélectivement le formaldéhyde, principalement sous forme de paraformaldéhyde avec des substrats éthyléniques variés. Les alcènes aromatiques, notamment ceux issus de la biomasse comme l’isoeugénol ou l’isosafrole, sont ainsi transformés quantitativement en dioxa-1,3 cyclohexanes correspondants avec une stéréosélectivité importante de la réaction en faveur de l’isomère trans.
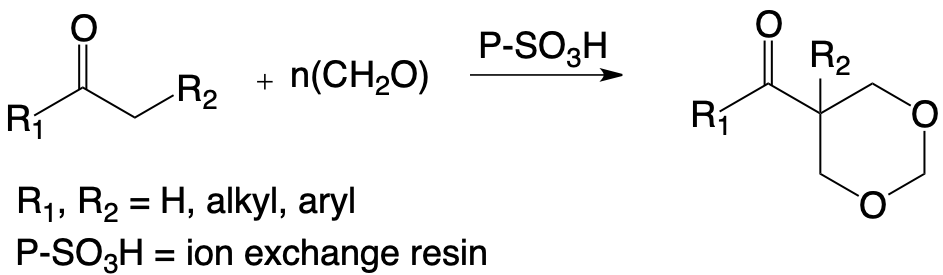
L’exploitation de l’équilibre céto-énolique de cétones ayant un groupe méthylène en alpha du carbonyle permet d’obtenir, dans d’excellentes conditions de rendement et de sélectivité des dioxa-1,3 cyclohexanes, certes différents de ceux obtenus à partir des alcènes, mais susceptibles d’applications dans de nombreux domaines.
La fonction énol stabilisée des phénols comme la vanilline réagit également dans ces conditions de réaction avec le formaldéhyde polymérisé pour conduire à des benzo (4 H) dioxinnes-1,3 avec des rendements et une sélectivité très supérieurs à ceux observés en milieu homogène.
L’analyse conformationnelle (RMN 1H, 13C, cristallographie…) permet de préciser la structure fine de ces molécules et contribue à l’établissement des différents mécanismes réactionnels.
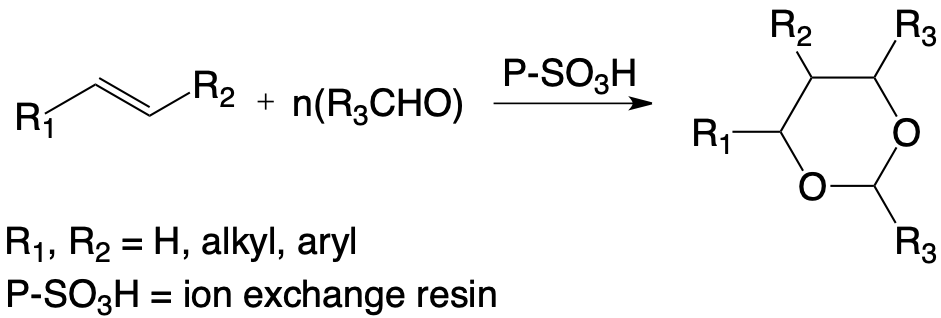
L’obtention de nouveaux composés dioxanniques avec des aldéhydes autres que le formaldéhyde inaccessibles par une autre voie de synthèse a donc nécessité la détermination des conditions optimales de condensation dépendant pour l’essentiel :
- du taux d’hydratation du milieu réactionnel,
- de la nature physique et chimique du réseau macromoléculaire de l’échangeur d’ions,
- de la nature du solvant organique.
La discussion des mécanismes réactionnels a mis en évidence des réactions de stéréo-isomérisation d’un nouveau type qui apparaissent entre les nouveaux différents dioxa-1,3 cyclohexanes stéréo-isomères obtenus à partir d’un même alcène.
Macrocycles phosphorés et azotés / Triazines saturées
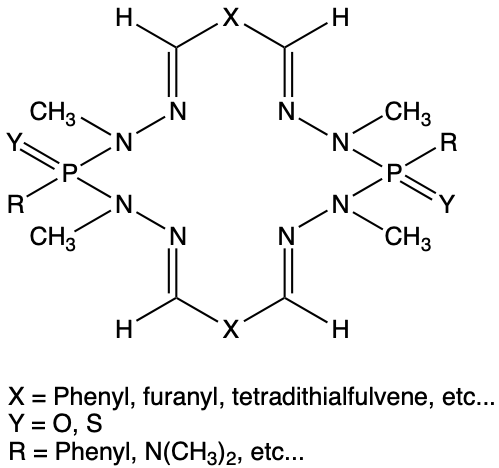
Il s’agit de la première synthèse de macrocycles réalisée sans catalyseur ionique par mise en contact de dialdéhydes diversement fonctionnalisés avec des phosphodihydrazides. Le rendement est quantitatif. Le 2,5- furane dicarboxaldéhyde et les dialdéhydes phénoliques dont la synthèse est rapportée dans las lignes qui suivent sont à l’origine des principaux macrocycles synthétisés. La première structure RX réalisée montre un arrangement structural rare : “en papillon”. Ces molécules peuvent être pontées, réduites ou oxydées vers une nouvelle classe de complexants sélectifs.
Cette technique originale a été appliquée pour fabriquer à partir de di et tétra-aminesfuraniques fabriquées pour l’ occasion de nouveaux macrocycles azotés qui sont de remarquables complexants sélectif du cation argent.
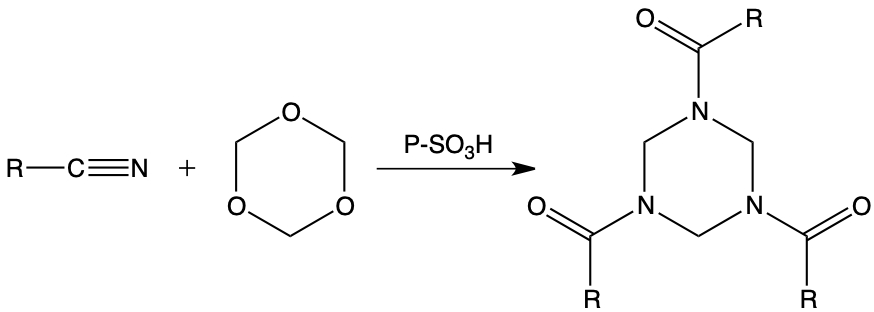
Une autre application intéressante de cette réactivité particulière du système formaldéhyde polymérisé / échangeurs d’ions cationiques en milieu organique faiblement hydraté concerne les nitriles saturés et insaturés qui, condensés avec le paraformaldéhyde en présence de résines échangeuses d’ions, conduisent aux triazines saturées correspondantes avec de remarquables rendements.
L’étude structurale de ces composés est réalisée parallèlement à l’établissement de schémas réactionnels compatibles avec les résultats de l’analyse des cinétiques des réactions.
Hétérocycles furaniques
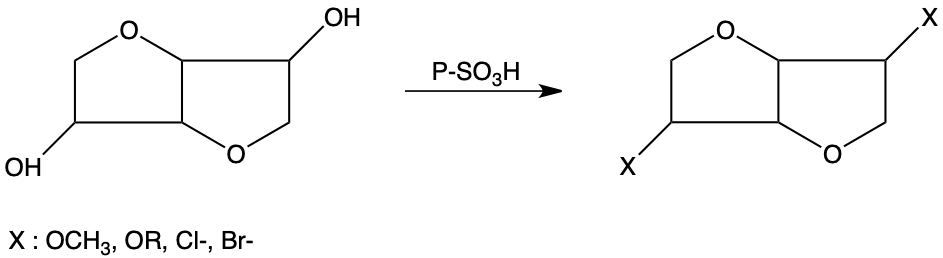
L’halogénation et l’alkylation de l’isosorbide et de l’isomannide conduit sélectivement à :
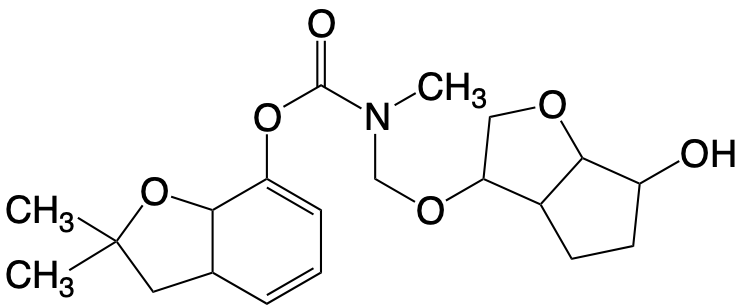
L’hydroxyméthylation par le formaldhéhyde permet le synthèse de carbamates diversement substitués